Йод в таблице менделеева: D1 82 d0 b0 d0 b1 d0 bb d0 b8 d1 86 d0 b0 d0 bc d0 b5 d0 bd d0 b4 d0 b5 d0 bb d0 b5 d0 b5 d0 b2 d0 b0 d0 b9 d0 be d0 b4 картинки, стоковые фото D1 82 d0 b0 d0 b1 d0 bb d0 b8 d1 86 d0 b0 d0 bc d0 b5 d0 bd d0 b4 d0 b5 d0 bb d0 b5 d0 b5 d0 b2 d0 b0 d0 b9 d0 be d0 b4
Йод
| Иод | |
|---|---|
| Атомный номер | 53 |
| Внешний вид простого вещества | |
| Свойства атома | |
|
Атомная масса (молярная масса) |
126,90447 а. е. м. (г/моль) |
| Радиус атома | n/a пм |
|
Энергия ионизации (первый электрон) |
1 008,3 (10,45) кДж/моль (эВ) |
| Электронная конфигурация | [Kr] 4d10 5s2 5p5 |
| Химические свойства | |
| Ковалентный радиус | 133 пм |
| Радиус иона | (+7e) 50 (-1e) 220 пм |
|
Электроотрицательность (по Полингу) |
2,66 |
| Электродный потенциал | 0 |
| Степени окисления | 7, 5, 3, 1, -1 |
| Термодинамические свойства простого вещества | |
| Плотность | 4,93 г/см³ |
| Молярная теплоёмкость | 54,44[1]Дж/(K·моль) |
| Теплопроводность | (0,45) Вт/(м·K) |
| Температура плавления | 386,7 K |
| Теплота плавления | 15,52 (I-I) кДж/моль |
| Температура кипения | 457,5 K |
| Теплота испарения | 41,95 (I-I) кДж/моль |
| Молярный объём | 25,7 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | орторомбическая |
| Параметры решётки | 7,720 Å |
| Отношение c/a | n/a |
| Температура Дебая | n/a K |
| I | 53 |
| 126,90447 | |
| 5s25p5 | |
| Иод | |
Иод, йод (от др. -греч. ιώδης, iodes — «фиолетовый») — элемент главной подгруппы седьмой группы, пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 53. Обозначается символом I (лат. Iodum). Химически активный неметалл, относится к группе галогенов. Простое вещество иод (CAS-номер: 7553-56-2) при нормальных условиях — кристаллы чёрно-серого цвета с фиолетовым металлическим блеском, легко образует фиолетовые пары, обладающие резким запахом. Молекула вещества двухатомна (формула I
-греч. ιώδης, iodes — «фиолетовый») — элемент главной подгруппы седьмой группы, пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 53. Обозначается символом I (лат. Iodum). Химически активный неметалл, относится к группе галогенов. Простое вещество иод (CAS-номер: 7553-56-2) при нормальных условиях — кристаллы чёрно-серого цвета с фиолетовым металлическим блеском, легко образует фиолетовые пары, обладающие резким запахом. Молекула вещества двухатомна (формула I
В медицине и биологии данное вещество обычно называют йодом (например «раствор йода»), в таблице Менделеева и химической литературе употребляется название иод.
История
Иод был открыт в 1811 г. Куртуа в золе морских водорослей, а с 1815 г. Гей-Люссак стал рассматривать его как химический элемент.
Символ элемента J был заменен на I относительно недавно, в 50-х годах XX века.
Нахождение в природе
В большом количестве находится в виде иодидов в морской воде.
Сырьём для промышленного получения йода в России служат нефтяные буровые воды, тогда как в зарубежных странах, не обладающих нефтяными месторождениями, используются морские водоросли, а также маточные растворы чилийской (натриевой) селитры, что намного удорожает производство йода из такого сырья.
Физические свойства
Пары имеют характерный фиолетовый цвет, так же, как и растворы в неполярных органических растворителях, например в бензоле — в отличие от бурого раствора в полярном спирте. Иод при комнатной температуре представляет собой темно-фиолетовые кристаллы со слабым блеском. При нагревании при атмосферном давлении он сублимируется (возгоняется), превращаясь в пары фиолетового цвета; при охлаждении пары иода кристаллизуются, минуя жидкое состояние. Этим пользуются на практике для очистки иода от нелетучих примесей.
При нагревании при атмосферном давлении он сублимируется (возгоняется), превращаясь в пары фиолетового цвета; при охлаждении пары иода кристаллизуются, минуя жидкое состояние. Этим пользуются на практике для очистки иода от нелетучих примесей.
Химические свойства
Иод образует ряд кислот: иодоводородную (HI), иодноватистую (HIO), иодистую (HIO
Химически иод довольно активен, хотя и в меньшей степени, чем хлор и бром.
- С металлами иод при легком нагревании энергично взаимодействует, образуя иодиды:
- Hg + I2 = HgI2
- С водородом иод реагирует только при нагревании и не полностью, образуя йодистый водород:
- I2 + H2 = 2HI
-
Элементный иод — окислитель, менее сильный, чем хлор и бром. Сероводород H
- I2 + H2S = S + 2HI
- При растворении в воде иод частично реагирует с ней:
- I2 + H2O = HI + HIO
Применение
Медицина
5%-ный спиртовой раствор йода используется для дезинфекции кожи вокруг повреждения (рваной, резаной или иной раны), но не для приёма внутрь при дефиците йода в организме.
Широко используется в альтернативной (неофициальной) медицине, однако его использование без назначения врача в основном мало обосновано, и нередко сопровождается различными рекламными заявлениями.
См. также
Производство аккумуляторов
Иод используется в качестве положительного электрода (окислителя) в литиево-иодных аккумуляторах для электромобилей.
Лазерный термоядерный синтез
Некоторые иодорганические соединения применяются для производства сверхмощных газовых лазеров на возбужденных атомах иода (исследования в области лазерного термоядерного синтеза и промышленность).
Радиоэлектронная промышленность
В последние годы резко повысился спрос на иод со стороны производителей жидкокристаллических дисплеев.
Динамика потребления иода
Мировое потребление иода в 2005 составило 25,5 тыс. тонн.
тонн.
Важность для человека
Недостаток йода приводит к заболеваниям щитовидной железы (например, к базедовой болезни, кретинизму) Так же при небольшом недостатке йода отмечается усталость, головная боль, подавленное настроение, природная лень, слабеет память и интеллект, нервозность и раздражительность. Со временем появляется аритмия, повышается артериальное давление, падает уровень гемоглобина в крови.
Биологическая роль
Иод относится к микроэлементам и присутствует во всех живых организмах. Его содержание в растениях зависит от присутствия его соединений в почве и водах. Некоторые морские водоросли (морская капуста, или ламинария, фукус и другие) накапливают до 1% иода. Иод входит в скелетный белок губок и скелетопротеинов морских многощетинковых червей.
У животных и человека иод входит в состав так называемых тиреоидных гормонов, вырабатываемых щитовидной железой — тироксина и трииодтиронина, оказывающих многостороннее воздействие на рост, развитие и обмен веществ организма.
В организме человека (масса тела 70 кг) содержится 12-20 мг иода, суточная потребность в иоде составляет около 0,2 мг (200 мкг). Отсутствие или недостаток иода в рационе (что типично для некоторых местностей) приводит к заболеваниям (эндемический зоб, кретинизм, гипотиреоз). В связи с этим к поваренной соли, поступающей в продажу в местностях с естественным геохимическим дефицитом иода, с профилактической целью добавляют иодид калия, иодид натрия или иодат калия (иодированная соль).
Токсичность
Иод — токсичное вещество. Смертельная доза 2-3 г. Вызывает поражение почек и сердечно-сосудистой системы. При вдыхании паров йода появляется головная боль, кашель, насморк, может быть отёк лёгких. При попадании на слизистую оболочку глаз появляется слезотечение, боль в глазах и покраснение. При попадании внутрь появляется общая слабость, головная боль, рвота, понос, бурый налёт на языке, боли в сердце и учащение пульса. Через день воспаляются почки, появляется кровь в моче. Если не лечить через 2-3 дня могут отказать почки и наступить миокардит. Без лечения наступает летальный исход.
Если не лечить через 2-3 дня могут отказать почки и наступить миокардит. Без лечения наступает летальный исход.
химический элемент Иод Iodium-Jodium — «Химическая продукция»
Что такое
Иод, iodium-jodium, характеристики, свойстваИод — это химический элемент I
Иод класс химических элементов
Элемент I — относится к группе, классу хим элементов ((тривиальное (общеупотребительное) название — йод; от греч. ἰώδης — «фиалковый (фиолетовый)») — химический элемент с атомным номером 53 Принадлежит к 17-й группе периодической таблицы химических элементов (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе VII группы, или к группе VIIA), находится в пятом периоде таблицы. Атомная масса элемента 126,90447 а. е. м..
Обозначается символом I (от лат. Iodum). Химически активный неметалл, относится к группе галогенов. Простое вещество иод при нормальных условиях — кристаллы чёрно-серого цвета с фиолетовым металлическим блеском, легко образует фиолетовые пары, обладающие резким запахом. Элементарный иод высокотоксичен.
Элементарный иод высокотоксичен.
Молекула простого вещества двухатомна) (формула I2 ).
Элемент I свойство химического элемента Иод Iodium-Jodium
Основные характеристики и свойства элемента I…, его параметры. 17-й группе периодической таблицы химических элементов (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе VII группы, или к группе VIIA), находится в 5 периоде.
Название и обозначение
Название элемента предложено Гей-Люссаком и происходит от др.-греч. ἰο-ειδής (букв. «фиалкоподобный»), что связано с цветом пара, который наблюдал французский химик Бернар Куртуа , нагревая маточный рассол золы морских водорослей с концентрированной серной кислотой. В медицине и биологии данный элемент и простое вещество обычно называют йодом , например, «раствор йода», в соответствии со старым вариантом названия, существовавшим в химической номенклатуре до середины XX века.
В современной химической номенклатуре используется наименование иод . Такое же положение существует в некоторых других языках, например, в немецком: общеупотребительное Jod и терминологически корректное Iod. Одновременно с изменением названия элемента в 1950-х годах Международным союзом общей и прикладной химии символ элементаJ был заменен на I .
Такое же положение существует в некоторых других языках, например, в немецком: общеупотребительное Jod и терминологически корректное Iod. Одновременно с изменением названия элемента в 1950-х годах Международным союзом общей и прикладной химии символ элементаJ был заменен на I .
История
Иод был открыт в 1811 г. Куртуа. При кипячении серной кислоты с рассолом золы морских водорослей он наблюдал выделение фиолетового пара, при охлаждении превращающегося в темные кристаллы с ярким блеском.
Элементарная природа иода установлена в 1811-1813 гг. Л.Ж. Гей-Люссаком ( а чуть позже и Х.Дэви). Гей-Люссак получил также многие производные ( HI , HIO 3 , I2 O5 , ICl и др.). Важнейшим природным источником иода служат буровые воды нефтяных и газовых скважин.
Нахождение в природе
Иод — редкий элемент. Его кларк — всего 400 мг/т. Однако он чрезвычайно сильно рассеян в природе и, будучи далеко не самым распространенным элементом, присутствует практически везде. Иод находится в виде иодидов в морской воде (20—30 мг на тонну морской воды). Присутствует в живых организмах, больше всего в водорослях (2,5 г на тонну высушенной морской капусты , ламинарии ).
Иод находится в виде иодидов в морской воде (20—30 мг на тонну морской воды). Присутствует в живых организмах, больше всего в водорослях (2,5 г на тонну высушенной морской капусты , ламинарии ).
Известен в природе также в свободной форме, в качестве минерала , но такие находки единичны, — в термальных источниках Везувия и на острове Вулькано ( Италия ). Запасы природных иодидов оцениваются в 15 млн тонн, 99 % запасов находятся в Чили и Японии . В настоящее время в этих странах ведётся интенсивная добыча иода, например, чилийская Atacama Minerals производит свыше 720 тонн иода в год. Наиболее известный из минералов иода — лаутарит Ca(IO 3 )2 . Некоторые другие минералы иода — иодобромит Ag(Br, Cl, I), эмболит Ag(Cl, Br), майерсит CuI·4AgI.
Сырьём для промышленного получения иода в России служат нефтяные буровые воды, тогда как в зарубежных странах, не обладающих нефтяными месторождениями, используются морские водоросли, а также маточные растворы чилийской (натриевой) селитры, щёлок калийных и селитряных производств, что намного удорожает производство иода из такого сырья
Физические свойства
Пары иода
Жидкий иод на дне химического стакана
Природный иод состоит только из одного изотопа — иода-127. Конфигурация внешнего электронного слоя — 5s 2 p5 . В соединениях проявляет степени окисления −1, 0, +1, +3, +5 и +7 (валентности I, III, V и VII).
Конфигурация внешнего электронного слоя — 5s 2 p5 . В соединениях проявляет степени окисления −1, 0, +1, +3, +5 и +7 (валентности I, III, V и VII).
Радиус нейтрального атома иода 0,136 нм, ионные радиусы I− , I5+ и I7+ равны, соответственно, 0,206; 0,058-0,109; 0,056-0,067 нм. Энергии последовательной ионизации нейтрального атома иода равны, соответственно: 10,45; 19,10; 33 эВ. Сродство к электрону −3,08 эВ. По шкале Полинга электроотрицательность иода — 2,66, иод принадлежит к числу неметаллов.
Иод при обычных условиях — твёрдое вещество, чёрно-серые или тёмно-фиолетовые кристаллы со слабым металлическим блеском и специфическим запахом.
Пары имеют характерный фиолетовый цвет , так же, как и растворы в неполярных органических растворителях, например, в бензоле — в отличие от бурого раствора в полярном этиловом спирте. Слабо растворяется в воде (0,28 г/л), лучше растворяется в водных растворах иодидов щелочных металлов с образованием трииодидов (например трииодида калия KI 3 ).
При нагревании при атмосферном давлении иод сублимирует (возгоняется), превращаясь в пары фиолетового цвета; при охлаждении при атмосферном давлении пары иода кристаллизуются, минуя жидкое состояние. Этим пользуются на практике для очистки иода от нелетучих примесей.
Жидкий иод можно получить, нагревая его под давлением.
Изотопы
Известны 37 изотопов иода с массовыми числами от 108 до 144. Из них только 127 I является стабильным, период полураспада остальных изотопов иода составляет от 103 мкс до 1,57⋅10 7 лет ; отдельные изотопы используются в терапевтических и диагностических целях.
Радиоактивный нуклид 131 I распадается с испусканием β-частиц (наиболее вероятные максимальные энергии — 0,248, 0,334 и 0,606 МэВ), а также с излучением γ-квантов с энергиями от 0,08 до 0,723 МэВ/
Химические свойства
Иод относится к группе галогенов.
Электронная формула ( Электронная конфигурация ) иода: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 5 .
Образует ряд кислот: иодоводородную (HI) , иодноватистую (HIO) , иодистую (HIO 2 ) , иодноватую (HIO 3 ) , иодную (HIO 4 ) .
Химически иод довольно активен, хотя и в меньшей степени, чем хлор и бром .
- Довольно известной качественной реакцией на иод является его взаимодействие с крахмалом , при котором наблюдается синее окрашивание в результате образования соединения включения. Эту реакцию открыли в 1814 году Жан-Жак Колен (Jean-Jacques Colin) и Анри-Франсуа Готье де Клобри (Henri-François Gaultier de Claubry) [13] .
- С металлами иод при легком нагревании энергично взаимодействует, образуя иодиды:
- Hg+I2→HgI2 {\\displaystyle {\\mathsf {Hg+I_{2}\\rightarrow HgI_{2}}}}
- С водородом иод реагирует только при нагревании и не полностью, образуя иодоводород :
- h3+I2→2HI {\\displaystyle {\\mathsf {H_{2}+I_{2}\\rightarrow 2HI}}}
- Иод является окислителем , менее сильным, чем фтор , хлор и бром .
 Сероводород H2 S , Na 2 S2 O3 и другие восстановители восстанавливают его до иона I− :
Сероводород H2 S , Na 2 S2 O3 и другие восстановители восстанавливают его до иона I− :
Последняя реакция также используется в аналитической химии для определения иода.
- При растворении в воде иод частично реагирует с ней (По «Началам Химии» Кузьменко: реакция не идёт даже при нагревании, текст нуждается в проверке)
- pKc =15,99
- Реакция образования нитрида трииода :
Нитрид трииода в сухом кристаллическом состоянии разлагается с выделением фиолетовых паров иода, что демонстрируется как эффектная химическая реакция.
- Иодиды щелочных металлов очень склонны в растворах присоединять (растворять) молекулы галогенов с образованием полииодидов (периодидов) — трииодид калия , дихлороиодат(I) калия :
Применение
В медицине
5 % спиртовой раствор иода
5-процентный спиртовой раствор иода используется для дезинфекции кожи вокруг повреждения (рваной, резаной или иной раны), но не для приёма внутрь при дефиците иода в организме. Продукты присоединения иода к крахмалу (т. н. « Синий йод » — Йодинол , Йокс , Бетадин и др.) являются более мягкими антисептиками .
Продукты присоединения иода к крахмалу (т. н. « Синий йод » — Йодинол , Йокс , Бетадин и др.) являются более мягкими антисептиками .
При большом количестве внутримышечных инъекций , на их месте пациенту делается йодная сетка — йодом рисуется сетка на площади, в которую делаются инъекции (например, на ягодицах ). Это нужно для того, чтобы быстро рассасывались «шишки», образовавшиеся в местах внутримышечных инъекций.
В качестве антисептика применяется всё реже и реже.
В рентгенологических и томографических исследованиях широко применяются йодсодержащие контрастные препараты .
Иод-131, как и некоторые радиоактивные изотопы иода (125 I, 132 I) применяются в медицине для диагностики и лечения заболеваний щитовидной железы . Изотоп широко применяется при лечении диффузно-токсического зоба (болезни Грейвса), некоторых опухолей. Согласно нормам радиационной безопасности НРБ-99/2009 , принятым в России, выписка из клиники пациента, лечившегося с использованием иода-131, разрешается при снижении общей активности этого нуклида в теле пациента до уровня 0,4 ГБк
В криминалистике
В криминалистике пары иода применяются для обнаружения отпечатков пальцев на бумажных поверхностях, например, на купюрах.
В технике: рафинирование металлов
Источники света
Иод используется в источниках света:
- галогеновых лампах — в качестве компонента газового наполнителя колбы для осаждения испарившегося вольфрама нити накаливания обратно на неё.
- металлогалогеновых дуговых лампах — в качестве газовой среды разряда используются галогениды ряда металлов, использование различных смесей которых позволяет получать лампы с большим разнообразием спектральных характеристик.
Производство аккумуляторов
Иод используется в качестве компонента положительного электрода (окислителя) в литиево-ионных аккумуляторах для автомобилей.
Лазерный термоядерный синтез
Некоторые иодорганические соединения применяются для производства сверхмощных газовых лазеров на возбужденных атомах иода (исследования в области лазерного термоядерного синтеза).
Радиоэлектронная промышленность
В последние годы резко повысился спрос на иод со стороны производителей жидкокристаллических дисплеев.
Динамика потребления иода
Мировое потребление иода в 2005 году составило 25,8 тыс. тонн
Биологическая роль
Иод относится к микроэлементам и присутствует во всех живых организмах. Его содержание в растениях зависит от присутствия его соединений в почве и водах. Некоторые морские водоросли ( морская капуста , ламинария , фукус и другие) накапливают до 1 % иода. Богаты иодом водные растения семейства рясковых. Иод входит в скелетный белок губок и скелетопротеинов морских многощетинковых червей.
Иод и щитовидная железа
У животных и человека иод входит в состав так называемых тиреоидных гормонов, вырабатываемых щитовидной железой — тироксина и трииодтиронина , оказывающих многостороннее воздействие на рост, развитие и обмен веществ организма.
В организме человека (масса тела 70 кг) содержится 12—20 мг иода. Суточная потребность человека в иоде определяется возрастом, физиологическим состоянием и массой тела. Для человека среднего возраста нормальной комплекции (нормостеник) суточная доза иода составляет 0,15 мг.
Отсутствие или недостаток иода в рационе (что типично для некоторых местностей) приводит к заболеваниям ( эндемический зоб , кретинизм, гипотиреоз). В связи с этим к поваренной соли , поступающей в продажу в местностях с естественным геохимическим дефицитом иода, с профилактической целью добавляют иодид калия , иодид натрия или иодат калия ( иодированная соль ).
Недостаток иода приводит к заболеваниям щитовидной железы (например, к базедовой болезни , кретинизму ). Также при небольшом недостатке иода отмечается усталость, головная боль, подавленное настроение, природная лень, нервозность и раздражительность; слабеет память и интеллект. Со временем появляется аритмия, повышается артериальное давление, падает уровень гемоглобина в крови.
Избыток йода в пище обычно легко переносится организмом, однако в отдельных случаях в людях с повышенной чувствительностью этот избыток может также привести к расстройствам щитовидной железы/
Токсичность
Иод токсичен. Смертельная доза (LD50) — 3 г. Вызывает поражение почек и сердечно-сосудистой системы. При вдыхании паров иода появляется головная боль, кашель, насморк, может быть отёк лёгких. При попадании на слизистую оболочку глаз появляется слезотечение, боль в глазах и покраснение. При попадании внутрь появляется общая слабость, головная боль, повышение температуры, рвота, понос, бурый налёт на языке, боли в сердце и учащение пульса. Через день появляется кровь в моче. Через 2 дня появляются почечная недостаточность и миокардит. Без лечения наступает летальный исход/
Смертельная доза (LD50) — 3 г. Вызывает поражение почек и сердечно-сосудистой системы. При вдыхании паров иода появляется головная боль, кашель, насморк, может быть отёк лёгких. При попадании на слизистую оболочку глаз появляется слезотечение, боль в глазах и покраснение. При попадании внутрь появляется общая слабость, головная боль, повышение температуры, рвота, понос, бурый налёт на языке, боли в сердце и учащение пульса. Через день появляется кровь в моче. Через 2 дня появляются почечная недостаточность и миокардит. Без лечения наступает летальный исход/
ПДК иода в воде 0,125 мг/дм³, в воздухе 1 мг/м³.
Радиоактивный иод-131 (радиойод), являющийся бета- и гамма-излучателем, особенно опасен для организма человека, так как радиоактивные изотопы биохимически не отличаются от стабильных. Поэтому почти весь радиоактивный иод, как и обычный, концентрируется в щитовидной железе, что приводит к её облучению и дисфункции. Основным источником загрязнения атмосферы радиоактивным иодом являются атомные станции и фармакологическое производство.
Свойство радиоиода позволяет использовать его для борьбы с опухолями щитовидной железы и диагностики её заболеваний (см. выше).
формула химического элемента Иод Iodium-Jodium
Химическая формула Иода:
Атомы Иод Iodium-Jodium химических элементов
Атомы Iodium-Jodium хим. элемента
Iodium-Jodium Иод ядро строение
Строение ядра химического элемента Iodium-Jodium — I,
История открытия Иод Iodium-Jodium
Открытие элемента Iodium-Jodium —
Иод Iodium-Jodium происхождение названия
Откуда произошло название Iodium-Jodium …
Распространённость Иод Iodium-Jodium
Как любой хим. элемент имеет свою распространенность в природе, I …
Получение Иод Iodium-Jodium
Iodium-Jodium — получение элемента
Физические свойства Иод Iodium-Jodium
Основные свойства Iodium-Jodium
Изотопы Iodium-Jodium Иод
Наличие и определение изотопов Iodium-Jodium
I свойства изотопов Иод Iodium-Jodium
…
Химические свойства Иод Iodium-Jodium
Определение химических свойств Iodium-Jodium
Меры предосторожности Иод Iodium-Jodium
Внимание! Внимательно ознакомьтесь с мерами безопасности при работе с Iodium-Jodium
Стоимость Иод Iodium-Jodium
Рыночная стоимость I, цена Иод Iodium-Jodium
Примечания
Список примечаний и ссылок на различные материалы про хим. элемент I
элемент I
Йод и его характеристики
Общая характеристика йода
Йод относится к редким (рассеянным) элементам, однако в природе его все-таки можно встретить в свободном состоянии в виде минерала (термальные источники вулкана Везувия). Значительное количество йода содержится в морской воде в виде солей йодидов или в земной коре в составе нефтяных буровых вод.
В виде простого вещества йод представляет собой кристаллы черно-серого (темно-фиолетового) цвета (рис. 1) с металлическим блеском и резким запахом. Пары йода, также, как и его растворы в органических растворителях, окрашены в фиолетовый цвет.
Рис. 1. Йод. Внешний вид.
Атомная и молекулярная масса йода
Относительная атомная масса безразмерна и обозначается Ar (индекс «r» — начальная буква английского слова relative, что в переводе означает «относительный»). Относительная атомная масса атомарного йода равна 126,9044 а.е.м.
Массы молекул, также как массы атомов выражаются в атомных единицах массы.
Молекулярной массой вещества называется масса молекулы, выраженная в атомных единицах массы. Известно, что молекула йода двухатомна – I2. Относительная молекулярная масса молекулы йода будет равна:
Mr(I2) = 126,9044 × 2 ≈ 254.
Изотопы йода
Известно, что в природе йод может находиться в виде единственного стабильного изотопа 127I. Массовое число равно 127, ядро атома изотопа содержит пятьдесят три протона и семьдесят четыре нейтрона.
Существуют искусственные нестабильные изотопы йода с массовыми числами от 108-ми до 144-х, а также семнадцать изомерных состояния ядер, среди которых наиболее долгоживущим является изотоп 129I с периодом полураспада равным 1,57×107 лет.
Ионы йода
На внешнем энергетическом уровне атома йода имеется семь электронов, которые являются валентными:
1s22s22p63s23p63d104s24p64d105s25р 5.
В результате химического взаимодействия йод отдает свои валентные электроны, т.е. является их донором, и превращается в положительно заряженный ион либо принимает электроны от другого атома, т.е. является их акцептором и превращается в отрицательно заряженный ион:
I0 -1e → I+;
I0 -3e → I3+;
I0 -5e → I5+;
I0 -7e → I7+;
I0 +1e → I—.
Молекула и атом йода
В свободном состоянии йод существует в виде двухатомных молекул I2. Приведем некоторые свойства, характеризующие атом и молекулу йода:
|
Энергия ионизации атома, эВ |
10,45 |
|
Относительная электроотрицательность |
2,66 |
|
Радиус атома, нм |
0,136 |
Примеры решения задач
химические свойства, формула расчета, номер в таблице Менделеева
Спиртовой раствор йода .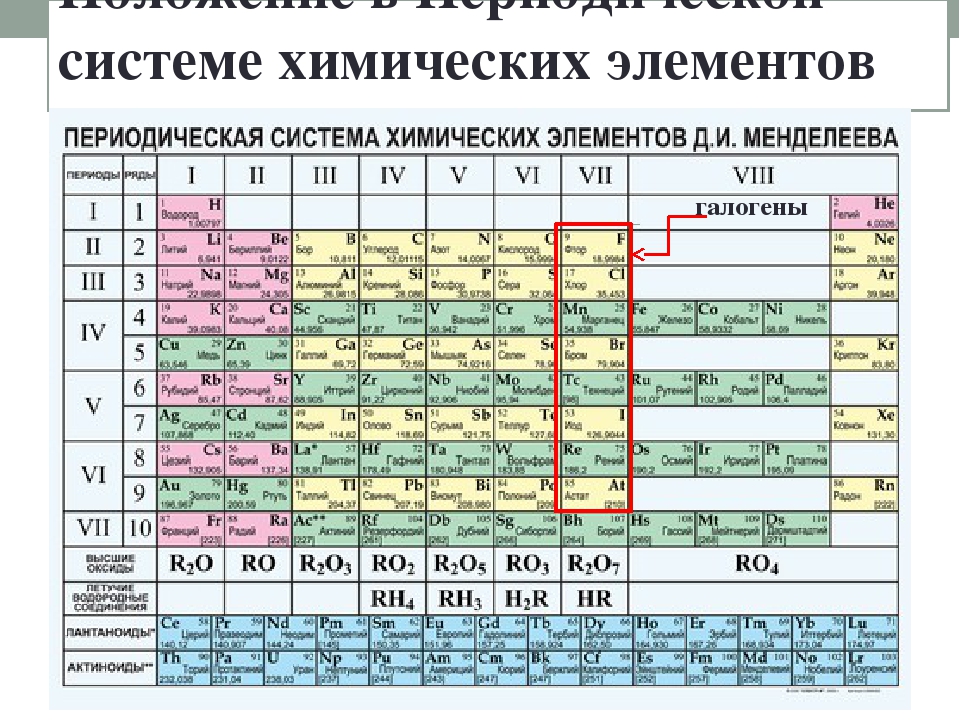 .. С детства хорошо знакомый всем детям и их родителям помощник при царапинах, ссадинах и порезах. Он является быстрым и эффективным средством, прижигающим и дезинфицирующим раневую поверхность. Однако сфера применения вещества не ограничивается только медициной, т. к. химические свойства йода очень разнообразны. Цель нашей статьи – ознакомиться с ними подробнее.
.. С детства хорошо знакомый всем детям и их родителям помощник при царапинах, ссадинах и порезах. Он является быстрым и эффективным средством, прижигающим и дезинфицирующим раневую поверхность. Однако сфера применения вещества не ограничивается только медициной, т. к. химические свойства йода очень разнообразны. Цель нашей статьи – ознакомиться с ними подробнее.
Физическая характеристика
Простое вещество имеет вид темно-фиолетовых кристаллов. При нагревании, вследствие особенностей внутреннего строения кристаллической решетки, а именно наличия в ее узлах молекул, соединение не расплавляется, а сразу образует пары. Это возгонка или сублимация. Она объясняется слабой связью между молекулами внутри кристалла, которые легко отрываются друг от друга – образуется газообразная фаза вещества. Номер йода в таблице Менделеева – 53. А его положение среди других химических элементов указывает на принадлежность к неметаллам. Остановимся на этом вопросе далее.
Место элемента в периодической системе
Йод находится в пятом периоде, VII группе и, наряду со фтором, хлором, бромом и астатом образует подгруппу галогенов. В связи с увеличением заряда ядра и атомного радиуса у представителей галогенов происходит ослабление неметаллических свойств, поэтому йод менее активен, чем хлор или бром, и его электроотрицательность также ниже. Атомная масса йода 126,9045. Простое вещество представлено двухатомными молекулами, как и у других галогенов. Ниже мы ознакомимся со строением атома элемента.
Особенности электронной формулы
Пять энергетических уровней и почти полностью заполненный электронами последний из них подтверждают наличие у элемента ярко выраженных признаков неметаллов. Как и другие галогены, йод является сильным окислителем, забирая у металлов и более слабых неметаллических элементов — серы, углерода, азота — недостающий до завершения пятого уровня электрон.
Йод – неметалл, в молекулах которого присутствует общая пара p-электронов, связывающая атомы между собой. Их плотность в месте перекрывания наибольшая, общее электронное облако не смещается ни к одному из атомов и располагается в центре молекулы. Формируется неполярная ковалентная связь, а сама молекула имеет линейную форму. В ряду галогенов, от фтора до астата, прочность ковалентной связи уменьшается. Наблюдается уменьшение величины энтальпии, от которой зависит распад молекул элемента на атомы. Какие же последствия для химических свойств йода это имеет?
Почему активность йода меньше, чем у других галогенов
Реакционная способность неметаллов определяется силой притягивания к ядру собственного атома чужих электронов. Чем меньше радиус атома, тем силы электростатического притяжения его отрицательно заряженных частиц других атомов выше. Чем выше номер периода, в котором расположен элемент, тем больше энергетических уровней он будет иметь. Йод находится в пятом периоде, и количество энергетических слоев у него больше, чем у брома, хлора и фтора. Именно поэтому молекула йода содержит атомы, имеющие радиус намного больше, чем у ранее перечисленных галогенов. Вот почему частицы I2 слабее притягивают электроны, что приводит к ослаблению их неметаллических свойств. Внутреннее строение вещества неизбежно влияет и на его физические характеристики. Приведем конкретные примеры.
Сублимация и растворимость
Уменьшение взаимного притягивания атомов йода в его молекуле приводит, как мы говорили ранее, к ослаблению прочности ковалентной неполярной связи. Происходит снижение устойчивости соединения к высокой температуре и повышение показателя термической диссоциации его молекул. Отличительная черта галогена: переход вещества при нагревании из твердого состояния сразу в газообразное, т. е. сублимация — это главная физическая характеристика йода. Его растворимость в органических растворителях, например сероуглероде, бензоле, этаноле, выше, чем в воде. Так, в 100 г воды при 20 °С может раствориться всего 0,02 г вещества. Эту особенность в лаборатории применяют для извлечения йода из водного раствора. Взболтав его с небольшим количеством H2S, можно наблюдать фиолетовое окрашивание сероводорода вследствие перехода в него молекул галогена.
Химические свойства йода
Взаимодействуя с металлами, элемент ведет себя всегда одинаково. Он притягивает валентные электроны атома металла, которые располагаются либо на последнем энергетическом слое (s-элементы, такие как натрий, кальций, литий и т. д.), либо на предпоследнем слое, содержащем, например, d-электроны. К ним относятся железо, марганец, медь и другие. В этих реакциях металл будет восстановителем, а йод, химическая формула которого I2, — окислителем. Поэтому именно эта высокая активность простого вещества является причиной его взаимодействия со многими металлами.
Заслуживает внимания взаимодействие йода с водой при нагревании. В щелочной среде реакция проходит с образованием смеси йодидной и иодноватой кислот. Последнее вещество проявляет свойства сильной кислоты и при дегидратации превращается в пятиокись йода. Если же раствор подкислить, то вышеназванные продукты реакции взаимодействуют между собой с образованием исходных веществ – свободных молекул I2 и воды. Данная реакция относится к окислительно-восстановительному типу, в ней проявляются химические свойства йода как сильного окислителя.
Качественная реакция на крахмал
Как в неорганической, так и в органической химии существует группа реакций, с помощью которых можно выявить в продуктах взаимодействия определенные виды простых или сложных ионов. Для обнаружения макромолекул сложного углевода – крахмала — часто применяют 5%-й спиртовой раствор I2. Например, на срез сырой картофелины капают несколько его капель, и окраска раствора становится синей. Такой же эффект мы наблюдаем при попадании вещества на любой крахмалосодержащий продукт. Эта реакция, в результате которой получается синий йод, широко применяется в органической химии для подтверждения присутствия полимера в исследуемой смеси.
О полезных свойствах продукта взаимодействия йода и крахмала известно давно. Его применяли в условиях отсутствия противомикробных медикаментозных препаратов для лечения диареи, язвы желудка в состоянии ремиссии, заболеваний дыхательной системы. Широкое распространение крахмальный клейстер, содержащий примерно 1 чайную ложку спиртового раствора йода на 200 мл воды, получил из-за дешевизны ингредиентов и простоты приготовления.
Однако нужно помнить, что синий йод противопоказан в терапии маленьких детей, людей, страдающих повышенной чувствительностью к йодосодержащим препаратам, а также больным базедовой болезнью.
Как неметаллы реагируют между собой
Среди элементов главной подгруппы VII группы с йодом вступает в реакцию фтор – самый активный неметалл, обладающий наивысшей степенью окисления. Процесс проходит на холоде и сопровождается взрывом. С водородом I2 взаимодействует при сильном нагревании, причем не до конца, продукт реакции – HI — начинает разлагаться на исходные вещества. Йодоводородная кислота достаточно сильная и хоть по своим характеристикам похожа на хлоридную кислоту, все же проявляет более выраженные признаки восстановителя. Как видно, химические свойства йода обусловлены его принадлежностью к активным неметаллам, однако элемент уступает по окислительной способности брому, хлору и, конечно же, фтору.
Роль элемента в живых организмах
Наибольшее содержание ионов I— находится в тканях щитовидной железы, где они входят в состав тиреотропных гормонов: тироксина и трийодтиронина. Они регулируют рост и развитие костной ткани, проведение нервных импульсов, скорость обмена веществ. Особенно опасен недостаток йодсодержащих гормонов в детском возрасте, так как возможна задержка психического развития и появление симптомов такого заболевания, как кретинизм.
Недостаточная секреция тироксина у взрослых связана с дефицитом йода в воде и продуктах питания. Она сопровождается выпадением волос, образованием отеков, снижением физической активности. Избыток элемента в организме также крайне опасен, так как развивается базедова болезнь, симптомы которой – возбудимость нервной системы, тремор конечностей, резкое исхудание.
Высокое содержание соединений йода обнаруживается у некоторых представителей мира флоры. Низшие растения – бурые и красные водоросли — накапливают их в своем талломе. Среди высших растений рекордсменами по накоплению йода являются вишня, хурма, финики и свекла. Большое количество элемента содержат морепродукты и морская рыба.
Распространение йодидов в природе и способы получения чистого вещества
Основная масса элемента присутствует в живых организмах и оболочках Земли – гидросфере и литосфере — в связанном состоянии. Соли элемента есть в морской воде, но их концентрация незначительна, поэтому извлекать чистый йод из нее нерентабельно. Гораздо эффективнее получение вещества из золы бурых водорослей: фукуса, ламинарии, саргассума.
В промышленных масштабах I2 выделяют из подземных вод в процессах добычи нефти. При переработке некоторых руд, например чилийской селитры, в ней встречаются иодаты и гипоиодаты калия, из которых в дальнейшем добывают чистый йод. Достаточно рентабельно получать I2 из раствора йодоводорода, окисляя его хлором. Полученное соединение является важным сырьем для фармацевтической промышленности.
Кроме уже названного 5% спиртового раствора йода, содержащего не только простое вещество, но и соль – иодид калия, а также спирт и воду, в эндокринологии по медицинским показаниям применяют такие препараты, как «Йод-актив» и «Йодомарин».
В районах с низким содержанием природных соединений, кроме йодированной пищевой соли, можно использовать такое лечебное средство, как «Антиструмин». Он содержит действующее вещество – йодид калия — и рекомендуется в качестве профилактического препарата, применяемого для предотвращения симптомов эндемического зоба.
Йод — это… Что такое Йод?
| Ио́д / Iodum (I) | |
|---|---|
| Атомный номер | 53 |
| Внешний вид простого вещества | |
| Свойства атома | |
| Атомная масса (молярная масса) | 126,90447 а. е. м. (г/моль) |
| Радиус атома | n/a пм |
| Энергия ионизации (первый электрон) | 1 008,3 (10,45) кДж/моль (эВ) |
| Электронная конфигурация | [Kr] 4d10 5s2 5p5 |
| Химические свойства | |
| Ковалентный радиус | 133 пм |
| Радиус иона | (+7e) 50 (-1e) 220 пм |
| Электроотрицательность (по Полингу) | 2,66 |
| Электродный потенциал | 0 |
| Степени окисления | 7, 5, 3, 1, -1 |
| Термодинамические свойства простого вещества | |
| Плотность | 4,93 г/см³ |
| Удельная теплоёмкость | 0,427 (I-I) Дж/(K·моль) |
| Теплопроводность | (0,45) Вт/(м·K) |
| Температура плавления | 386,7 K |
| Теплота плавления | 15,52 (I-I) кДж/моль |
| Температура кипения | 457,5 K |
| Теплота испарения | 41,95 (I-I) кДж/моль |
| Молярный объём | 25,7 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | орторомбическая |
| Период решётки | 7,720 Å |
| Отношение c/a | n/a |
| Температура Дебая | n/a K |
| I | 53 |
| 126,90447 | |
| 5s25p5 | |
| Иод | |
Иод, йод (новолат. iodum от др.-греч. ἰοειδής, iodes — фиолетовый) — 53 элемент периодической системы элементов.
В медицине и биологии данное вещество обычно называют йодом (например «раствор йода»), в таблице Менделеева и химической литературе употребляется название иод.
История
Иод был открыт в 1811 г. Куртуа в золе морских водорослей, а с 1815 г. Гей-Люссак стал рассматривать его как химический элемент.
Символ элемента, J был заменен на I относительно недавно, в 50-х годах XX века.
Нахождение в природе
Известен в природе также в свободной форме, в качестве минерала, но такие находки единичны, — в термальных источниках Везувия и на о. Вулькано (Италия). Запасы природных иодидов оценваются в 15 млн тонн, 99 % запасов находятся в Чили и Японии. В настоящее время в этих странах ведётся интенсивная добыча иода, например, чилийская Atacama Minerals производит свыше 720 тонн иода в год.
Физические свойства
Пары имеют характерный фиолетовый цвет, так же, как и растворы в неполярных органических растворителях, например в бензоле — в отличие от бурого раствора в полярном спирте. Иод при комнатной температуре представляет собой темно-фиолетовые кристаллы со слабым блеском. При нагревании при атмосферном давлении он сублимируется (возгоняется), превращаясь в пары фиолетового цвета; при охлаждении пары иода кристаллизуются, минуя жидкое состояние. Этим пользуются на практике для очистки иода от нелетучих примесей.
Химические свойства
Иод образует ряд кислот: иодоводород (HI), иодноватистую (HIO), иодистую (HIO2), иодноватую (HIO3), иодную (HIO4).
Химически иод довольно активен, хотя и в меньшей степени, чем хлор и бром.
- Hg + I2 = HgI2
- I2 + H2 = 2НI
- I2 + H2S = S + 2НI
- При растворении в воде иод частично реагирует с ней:
- I2 + H2O = HI + HIO
Применение
Медицина
5%-ный спиртовой раствор йода используется для дезинфекции кожи вокруг повреждения (рваной, резаной или иной раны), но не для приёма внутрь при дефиците йода в организме. Продукты присоединения йода к крахмалу, другим ВМС («Синий йод» — Йодинол, Йокс, Бетадин) являются более мягкими антисептиками.
Широко используется в альтернативной (неофициальной) медицине, однако его использование без назначения врача в основном мало обосновано, и нередко сопровождается различными рекламными заявлениями.
Производство аккумуляторов
Иод используется в качестве положительного электрода (окислителя) в литиево-иодных аккумуляторах для электромобилей.
Лазерный термоядерный синтез
Некоторые иодорганические соединения применяются для производства сверхмощных газовых лазеров на возбужденных атомах иода (исследования в области лазерного термоядерного синтеза и промышленность).
Радиоэлектронная промышленность
В последние годы резко повысился спрос на иод со стороны производителей жидкокристаллических дисплеев.
Динамика потребления иода
Мировое потребление иода в 2005 составило 25,5 тыс. тонн.
Важность для человека
Недостаток йода приводит к заболеваниям щитовидной железы
Биологическая роль
Иод относится к микроэлементам и присутствует во всех живых организмах. Его содержание в растениях зависит от присутствия его соединений в почве и водах. Некоторые морские водоросли (морская капуста, или ламинария, фукус и другие) накапливают до 1 % иода. Иод входит в скелетный белок губок и скелетопротеинов морских многощетинковых червей.
У животных и человека иод входит в состав так называемых тиреоидных гормонов, вырабатываемых щитовидной железой — тироксина и трииодтиронина, оказывающих многостороннее воздействие на рост, развитие и обмен веществ организма.
В организме человека (масса тела 70 кг) содержится 12-20 мг иода, суточная потребность в иоде составляет около 0,2 мг (200 мкг). Отсутствие или недостаток иода в рационе (что типично для некоторых местностей) приводит к заболеваниям (эндемический зоб, кретинизм, гипотиреоз). В связи с этим к поваренной соли, поступающей в продажу в местностях с естественным геохимическим дефицитом иода, с профилактической целью добавляют иодид калия, иодид натрия или иодат калия (иодированная соль).
См. также
Ссылки
Wikimedia Foundation. 2010.
Тот, кто гасит свет. Фейнманий и глубины таблицы Менделеева / Хабр
Попробуйте почитайте англоязычные источники по истории химии и поищите в них упоминание таблицы Менделеева. Вы будете удивлены, но все-таки убедитесь, что такая формулировка тщательно избегается. Настойчиво и как-то политкорректно пишут о «периодической системе элементов». С упоминанием не только Менделеева, но и всех причастных, акцентируя роль Мейера, Деберейнера и Шанкуртуа с не меньшим пафосом, чем определяющую роль открытия второго фронта на заключительном этапе Второй мировой войны.
Отдавая должное уважаемым западным партнерам Менделеева и лично Роберту Бунзену, у которого Дмитрий Иванович учился в 1859-1861, отметим, что Менделеев вошел в историю науки не как классификатор известного, подобно Линнею, а как визионер, сумевший спрогнозировать еще не открытые элементы и, что более важно в контексте этой статьи – правильно расположить йод и теллур, несмотря на то, что теллур тяжелее йода.
В настоящее время таблицу Менделеева замыкает оганессон (Og) № 118. Он расположен ровно под радоном (№ 86) и, по логике Менделеева, должен представлять собой благородный газ, так как замыкает седьмой период. Но с завершением этого самого удивительного, эфемерного и взрывоопасного периода, вместившего в себя уран, плутоний, менделевий, флеровий и оганессон, вновь актуализируются вопросы: а где заканчивается таблица Менделеева? И до самого ли ее предела соблюдается периодический закон? Удивительно, но впервые ответ на этот вопрос довольно уверенно дал еще Ричард Фейнман.
При этом он опирался на традиционную модель атома, предложенную Бором. Как известно, в модели Бора ядро атома окружено облаком электронов, и электроны обращаются вокруг ядра лишь по строго определенным разрешенным орбитам. Электрон не может занимать промежуточную орбиту, но может переходить с одной разрешенной орбиты на другую. Такой переход происходит мгновенно с излучением или поглощением кванта энергии и называется «квантовый скачок».
Скорость электрона в конкретном квантовом состоянии вычисляется по следующей формуле
,
где Z – атомный номер, соответствующий количеству протонов в ядре атома и, соответственно, количеству электронов, обращающихся вокруг нейтрального атома. Здесь же n – это квантовое состояние электрона, а — постоянная тонкой структуры. Постоянная тонкой структуры вычисляется по формуле
,
где e – элементарный заряд, h – постоянная Планка, а e0 – диэлектрическая постоянная, также именуемая свободной проницаемостью вакуума.
Соответственно, чем дальше от ядра находится внешняя электронная оболочка атома, тем выше скорость движущегося по ней электрона. Ричард Фейнман вычислил, что при Z = 137 скорость электрона будет чуть ниже, чем скорость света. Если следовать этой логике, элемент с атомным номером 138 существовать не может; в противном случае, его крайний электрон превысил бы скорость света.
Резерфордий и беззаконие
Тем не менее, на практике все оказывается сложнее. Во-первых, в ядрах тяжелых и сверхтяжелых элементов начинают проявляться релятивистские эффекты. Расчеты, прогнозирующие, где может закончиться таблица Менделеева, основаны на теории относительности. При увеличении ядра в нем становится все больше протонов, а значит, возрастает и сила притяжения, воздействующая на электроны. Соответственно, скорость крайних электронов растет, все существеннее приближаясь к скорости света. При таких скоростях электроны становятся «релятивистскими», и свойства этих элементов не вполне объяснимы одним лишь положением элемента в таблице. Некоторые из подобных эффектов заметны невооруженным глазом. Так, в атомах золота электроны обращаются вокруг ядра со скоростью примерно вдвое меньше световой. Из-за этого очертания орбиталей изменяются так, что золото поглощает голубую часть видимого спектра, а остальные фотоны от него отражаются. Мы наблюдаем белый свет минус сине-фиолетовую составляющую, и в результате золото приобретает характерный желто-рыжий блеск, которым выделяется на фоне окружающих его серебристых металлов.
Еще в 1990-е были поставлены первые эксперименты, показавшие, что резерфордий (104) и дубний (105) проявляют не те свойства, что положены им в соответствии с позициями в периодической системе. Согласно периодическому закону, они должны напоминать по свойствам те элементы, что расположены прямо над ними, соответственно, гафний и тантал. На самом же деле, резерфордий реагирует подобно плутонию, расположенному довольно далеко от него, а дубний – как протактиний. С другой стороны, сиборгий (106) и борий (107) следуют закону, выведенному Менделеевым.
Дальше – больше. Оказывается, рентгений (111) сближается по свойствам с астатом, а не с золотом, а коперниций (112) тяготеет по свойствам к благородным газам, даже сильнее, чем оганессон (118). Вероятно, теннессин (117) по свойствам скорее похож на галлий, а нихоний (113) сравним со щелочными металлами. Все эти аномалии связаны со все более выраженным проявлением релятивистских эффектов в сверхкрупных атомах.
Немного о корпускулярно-волновом дуализме
Боровская модель атома в той трактовке, согласно которой таблицу должен замыкать элемент № 137, также не вполне соответствует реальному положению вещей. Предмет квантовой физики гораздо сложнее, чем предмет классической; как правило, квантовые феномены не имеют наглядного аналога на макроуровне. Например, в соответствии с законами классической физики, электроны, обращающиеся вокруг ядра, обязаны падать на ядро, а атомы – схлопываться.
Казалось бы, само существование атома является опровержением законов физики. Но на самом деле все иначе. Классические законы непоколебимы, но электроны не падают на ядро, поскольку, строго говоря, электрон – не частица. Электрон подчиняется корпускулярно-волновому дуализму, то есть, одновременно проявляет черты частицы и волны, и поэтому не падает на ядро. Тем не менее, даже с учетом корпускулярно-волнового дуализма скорость электрона не может превышать скорость света в вакууме.
Мистер Фейнман собственной персоной
Ричард Фейнман считал, что при атомном числе более Z =137 нейтральный атом существовать не может. Дело в том, что, согласно релятивистскому уравнению Дирака, при больших значениях Z основное энергетическое состояние электрона, ближайшего к ядру, будет выражаться мнимым числом. Однако, такая аргументация предполагает, что ядро является точечным. Если же допустить, что ядро имеет пусть минимальный, но не нулевой физический размер, то таблица Менделеева должна продолжаться до Z≈173.
Что дальше
Считается, что для
Z≈ 173 1s-подоболочка под действием электрического поля ядра «погружается» в отрицательный континуум (
море Дирака), что приводит к спонтанному рождению электрон-позитронных пар и, как следствие, к отсутствию нейтральных атомов выше элемента Ust (Унсепттрий) с
Z= 173. Атомы с
Z > Zcr173 называются
суперкритическимиатомами. Предполагается также, что элементы с
Z > Zcrмогут существовать только в качестве ионов.
Суперкритические атомы не могут быть полностью ионизированы, поскольку на их первой электронной оболочке будет бурно происходить спонтанное рождение пар, при котором из моря Дирака всплывают электрон и позитрон, причем, электрон вплетается в атом, а позитрон улетает. Правда, поле сильного взаимодействия, окружающее атомное ядро, очень короткодействующее, так что принцип запрета Паули не допускает дальнейшего спонтанного рождения пар после заполнения тех оболочек, что погружены в море Дирака. Элементы 173–184 названы слабо суперкритическими атомами, поскольку у них в море Дирака погружена только оболочка 1s; предполагается, что оболочка 2p1/2 будет полностью заполняться около элемента 185, а оболочка 2s – около элемента 245. Пока не удалось экспериментально добиться спонтанного рождения пар, пытаясь собрать суперкритические заряды путем столкновения тяжелых ядер (например, свинца с ураном, что могло бы дать Z = 174; урана с ураном, что дает Z = 184 и урана с калифорнием, что дает Z = 190). Возможно, в финале таблицы Менделеева ключевую роль будет играть ядерная нестабильность, а не нестабильность электронных оболочек.
Наконец, предполагается, что в регионе за Z > 300 может скрываться целый континент стабильности, состоящий из гипотетической кварковой материи (она же – квантово-хромодинамическая материя). Такая материя может состоять из свободных верхних и нижних кварков, а не из кварков, связанных в протоны и нейтроны. Предполагается, что это основное состояние барионной материи, обладающей большей энергией связи на барион, чем ядерная материя. Если такое состояние вещества реально, то, возможно, синтезировать его можно в ходе термоядерных реакций обычных сверхтяжелых ядер. Продукты таких реакций, благодаря высокой энергии связи, должны вполне преодолевать кулоновский барьер.
Пока все это теория, и мы, повторимся, успели заполнить лишь 7-й период таблицы Менделеева к 150-летию открытия Периодического Закона (1869-2019). Так или иначе, период полураспада новых тяжелых элементов стремительно сокращается; если у резерфордия-267 он составляет около 1,3 часов, то у рентгения-282 – всего 2,1 минуты, а у оганессона исчисляется сотнями микросекунд. Таким образом, финал близок, а за ним может открыться сиквел или режиссерская версия материального мира. Путь туда лежит через субсветовые орбитали фейнмания.
Почему йод есть в периодической таблице Менделеева, а зеленки нет?
Человек настроения — Жгучая брюнеткаПочему йод есть в периодической таблице Менделеева, а зеленки нет?
Комментарии
| все ровно сотрут темку))) зря стараешься..))) |
Человек настроения — Жгучая брюнетка да и пусть.. что мне, жалко что ли |
ЧУДО_вище на ваши темы да же отвечать нехочеться!!! всё равно удалят!!! (((только «умную» мыслю выскажишь, а темки-то ту-ту нема… |
Человек настроения — Жгучая брюнетка а Вы в личку… личку..тамне удялят |
ЧУДО_вище в личку только вы мою мыслю прочтёте, а как же остальные? может кому поможет! |
Валюшка_777 создай свою тему, и выписывай туда все свои умные мысли;) |
ЧУДО_вище а оно мне надо?)))))))))) |
Валюшка_777 ты ж сам беспокоился, что умные мысли «пропадают» |
ЧУДО_вище я их по другим темкам раскидаю.))) |
Человек настроения — Жгучая брюнетка Модераторыыыыы не удаляйте..аасьььь ну пожаалллстааа |
Человек настроения — Жгучая брюнетка А меня не.. я просто нашла список тупых вопросов. А то скучно.. да и еще можно самых вумных понервировать |
| Х его з…. У создателя Менделеева надо спросить… |
Песчаный зверь Комментарий удален! |
Человек настроения — Жгучая брюнетка Комментарий удален! |
Песчаный зверь ..нет..но наслышана..))…чтоб что то знать не обязательно это видеть..) |
| Сейчас будет очень умный ответ:-))) видимо, потому, что йод приснился Менделееву, а зелёнка нэт:-))))))))))))) |
Профессор кадровых наук Йод — химический элемент. Зеленка- составной. По-моему, сульфат. |
Человек настроения — Жгучая брюнетка (да я то знаю ответ на этот вопрос) |
Валюшка_777 не зеленка а бриллиантовый зеленый. И никакой не сульфат, а органическое соединение) |
Человек настроения — Жгучая брюнетка А те, кто плохо ко мне относится, я очень прошу не писать гадости. И в личку не писать тоже…даже о том что Вы на моей стороне. Спасибо. |
ЧУДО_вище Комментарий удален! |
Человек настроения — Жгучая брюнетка Да вы что… ну откуда вам знать. а вам я написала потому что там писать не хочу. |
ЧУДО_вище я вас понял. |
Человек настроения — Жгучая брюнетка фильтрую не нужных |
ЧУДО_вище я то же так делаю |
Валюшка_777 йаду там..полтаблицы. Но он шифруется)) |
| Почему, почему… «Рылом не вышла»)) |
Йод — Информация об элементе, свойства и использование
Расшифровка:
Химия в ее элементе: йод
(Promo)
Вы слушаете Химию в ее элементе, представленную вам Chemistry World , журналом Королевского химического общества.
(Конец промо)
Крис Смит
Здравствуйте, на этой неделе кретины, крекеры и чистая вода.История начинается в Италии, а вот и Андреа Селла.
Андреа Селла
Когда я был ребенком, каждое лето я проводил пару недель высоко в итальянских Альпах в идиллической маленькой деревушке под названием Конь, которая тихо уютно устроилась между высокими покрытыми льдом пиками. Для большинства итальянцев это имя ассоциируется с сенсационным убийством. Другие знают, что зимой в долине одни из лучших мест для ледолазания в Альпах. Но для меня Конь всегда будет связан с йодом.
Однажды днем, когда мне было около 10 лет, возвращаясь с папой из долгой прогулки, мы миновали унылое серое здание на окраине деревни. Он был окружен высоким металлическим забором и выглядел как учреждение. На скамейке в одиночестве сидел странно выглядящий старик — у него были взлохмаченные волосы, пустой взгляд и большой вздутый мешочек кожи на месте шеи. Я был совершенно потрясен этим странным существом. Я приставал к отцу вопросами.Кто он был? Что с ним не так? Почему он выглядел таким грустным?
Мой отец, чье терпение перед шквалом вопросов было почти безграничным, объяснил, что бедняк вырос с недостаточным содержанием йода в рационе. Йод, продолжал он, необходим для правильного развития щитовидной железы шеи, и что, если человек не будет есть правильную соль, особенно в детстве, у него может развиться зоб, а также пострадает умственное развитие. . Позже я читал об английских путешественниках, проходящих через Альпы, о Кретинских долинах — путевые книги того периода часто содержат мрачные иллюстрации этих несчастных.Цифры ошеломляют; Наполеоновская перепись населения кантона Вале в 1800 году обнаружила 4000 кретинов при населении 70 000 человек — более чем у 50% был бы зоб.
Болезнь была известна писателям-медикам на протяжении веков. Гален, например, рекомендовал лечение морскими губками. В 1170 году Роджер Салерно рекомендовал морские водоросли. Аналогичные предложения были сделаны и в Китае.
Парацельс, великий целитель, алхимик и писатель эпохи Возрождения, был одним из первых, кто заметил связь между зобом и кретинизмом, и первым предположил, что минералы в питьевой воде могут играть роль в возникновении этого состояния.Но что это за загадочные минералы, оставалось загадкой.
В 1811 году молодой французский химик Бернар Куртуа, работая в Париже, наткнулся на новый элемент. Фирма его семьи производила селитру, необходимую для производства пороха для наполеоновских войн. Для этого использовали древесную золу. Нехватка древесины во время войны вынудила их вместо этого сжигать водоросли, которых было много на побережье северной Франции. Добавив к золе концентрированную серную кислоту, Куртуа получил удивительно пурпурный пар, который кристаллизовался на стенках контейнера.Пораженный этим открытием, он запаковал кристаллы в бутылки и отправил их одному из ведущих химиков своего времени Жозефу Гей-Люссаку, который подтвердил, что это новый элемент, и назвал его иодом — йод — в честь греческого слова, обозначающего фиолетовый. Куртуа продолжал играть с элементом и был довольно шокирован, обнаружив, что при смешивании с аммиаком он дает твердое вещество шоколадного цвета, которое взрывается при малейшей провокации. Его современнику, Пьеру Дюлонгу, повезло меньше: он потерял глаз и часть руки при изучении материала, став первым в длинном списке жертв из-за этого неприятного материала.
Ядовитые качества йода вскоре были осознаны, и настойка, представляющая собой желтовато-коричневый раствор, стала широко использоваться в качестве дезинфицирующего средства. Даже сегодня самые распространенные таблетки для очистки воды, которые можно купить в туристических магазинах, основаны на йоде.
Спустя всего два года после его открытия врач в Женеве Франсуа Коиндэ начал задаваться вопросом, не является ли йод в водорослях отсутствующим минералом, ответственным за зоб. Поэтому он начал давать своим пациентам настойку йода перорально, что было неприятным делом, но, по его словам, это привело к исчезновению опухоли через 6-10 недель.Его коллеги, однако, обвинили его в отравлении своих пациентов, и в какой-то момент он, как утверждается, не мог выходить на улицу из-за страха подвергнуться нападению.
Но, хотя элементарный йод явно был токсичен , Коиндет был на правильном пути, и в течение 19 -го века, сделав шаг вперед на два шага назад, гипотеза постепенно завоевала доверие по мере экспериментов с более вкусной солью. , йодид калия, показал, что зоб можно вылечить. К началу 1920-х годов швейцарские кантоны начали вводить йодированную соль, и в последующие десятилетия многие страны, страдающие от зоба, последовали их примеру, и эта политика была настолько эффективной, что многие из нас в развитом мире не знали, насколько серьезной была эта болезнь, и слово кретин во многом потеряло свое значение.
Когда я вернулся в Конь прошлым летом, я попытался вспомнить, где был институт. Все, что я смог найти, это летний лагерь для отдыха, где дети весело играли за воротами, где я видел старика. Я позвонил своему отцу, чтобы спросить его, и мы поговорили о былых временах — плохих старых временах кретинов — и о призраках, изгнанных этим уникальным пурпурным элементом — йодом.
Крис Смит
Призраки, которые явно живут среди британской аристократии. Это химик из Калифорнийского университета в Лос-Анджелесе Андреа Селла рассказывал историю о йоде, элементе номер 53.На следующей неделе мы направим внимание на вещество, которое вообще не нуждается в освещении, потому что оно излучает собственный свет.
Брайан Клегг
Его считали источником энергии и яркости, его использовали в зубных пастах и патентованных лекарствах — его даже втирали в кожу головы как средство для восстановления волос.
Но применение радия, которое принесло ему известность, заключалось в его использовании в светящейся в темноте краске. Жуткое синее свечение радия, часто используемое для обеспечения световых индикаторов на часах, переключателях самолетов и циферблатах приборов, считалось безвредным и практичным источником ночного освещения.И только когда несколько рабочих, которые красили светящиеся циферблаты, начали страдать от язв, анемии и рака вокруг рта, стало ясно, что что-то не так.
Крис Смит
И вы можете услышать историю радия от Брайана Клегга на следующей неделе в «Химии в его стихии». Надеюсь, вы присоединитесь к нам. Я Крис Смит, спасибо за внимание и до свидания.
(промо)
(конец промо)
интригующий элемент йод | Таблица Менделеева
Йод — неметаллический твердый элемент в таблице Менделеева, который принадлежит к семейству галогенов.Этот элемент выделяется своим темным, блестящим серо-сине-черным цветом. Это самый тяжелый из стабильных галогенов, он очень летуч, легко образует пурпурный пар, который легко увидеть. Это важный минерал для здоровья человека, который добавляют в соль в большинстве регионов мира. Этот эффектный элемент обязательно будет интересным.
Cool Iodine Facts
- Название йода происходит от греческого слова «ioeides», что означает фиолетовый.
- Как и висмут, йод играет решающую роль в фармацевтической промышленности.Атомы галогена иногда включаются в препараты свинца, которые являются отправной точкой при разработке лекарств. В результате получается липофильный препарат, то есть он не очень растворим в воде и неполярен. Неполярные препараты могут легко переноситься через липидные мембраны и ткани. Добавление галогенов улучшает это свойство.
- В океане содержится больше йода, чем в земной коре. В частности, водоросли содержат высокие концентрации этого элемента.
- Единственный встречающийся в природе изотоп йода — это йод-127.В отличие от чистого йода, он существует сам по себе в природе. Другие изотопы созданы человеком.
- Йод-131 — важный радиоактивный изотоп. Его период полураспада составляет восемь дней. Он используется в медицине для регулирования работы щитовидной железы, лечения зоба, рака щитовидной железы и обнаружения опухолей.
- Йод-129 переходит из радиоактивной формы в нерадиоактивную в течение миллионов лет. Другие радиоактивные изотопы переходят в нерадиоактивную форму за считанные секунды или дни.
- С 1994 по 2000 год мировое производство йода увеличилось с 13 726 тонн до 18 993 тонн.
Йод в периодической таблице
Йод с атомным символом I — это неметалл, который находится в группе 17 периодической таблицы, галогены. Йод находится ниже брома, выше астата, справа от теллура и слева от ксенона. Его водный химический состав аналогичен химическому составу брома.
Электроотрицательность йода составляет 2,66. Атом йода имеет электронную конфигурацию [Kr] 4d 10 5s 2 5p 5 или 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 5
Йод по сравнению с другими галогенами
Элемент йод принадлежит к семейству галогенов, наряду с фтором, хлором, бромом и астатом.Все галогены обладают высокой электроотрицательностью и высокой реакционной способностью. Однако по сравнению с членами своего семейства йод относительно менее реактивен. Тем не менее, он обладает наибольшей восстанавливающей силой и легко получает электроны от других атомов. Из семейства галогенов йод наименее растворим в воде, его значение растворимости составляет 0,03 грамма на 100 граммов воды. Однако он противоположно реагирует с водными растворами йодида, где он очень растворим. В частности, этот элемент хорошо реагирует с растворами, содержащими йодид калия (KI + I 2 → KI 3 ).KI снижает давление пара и разбавляет йод, делая его более безопасным.
Йод в природе
Из семейства галогенов йод является наименее распространенным. В природе чистый йод никогда не бывает одиноким. Вместо этого он существует в виде соединений. Помимо земной коры, этот элемент находится в морской воде. Кроме того, тироксин, секрет щитовидной железы человека, содержит йод.
Сублиматы йода: факт или вымысел?
Что такое сублимация ? Обычно, когда твердое вещество испаряется, оно сначала должно превратиться в жидкость.Когда твердое вещество сублимируется, оно напрямую превращается в пар, полностью минуя жидкую фазу. Это эндотермический переход, который происходит только тогда, когда температура и давление ниже тройного нуля. Для йода тройная точка составляет 113,5 ° C при 12,1 кПа. Многие считают, что в этих условиях твердый йод сублимируется в газ. Однако это неправильное .
Существует большое заблуждение о том, что йод не может быть жидкостью, идея, что даже некоторые учебники виноваты в преподавании.При нормальном давлении и в диапазоне температур от 113,6 до 184,4 ° C (от 236,48 до 363,92 ° F) йод существует в виде жидкости. Это заблуждение обусловлено двумя факторами: во-первых, йод очень летуч. Это позволяет легко объяснить, как твердый йод может просто испаряться. Во-вторых, трудно увидеть жидкое состояние йода; Интенсивный фиолетовый цвет облака пара полностью перекрывает жидкость.
Как показано на диаграмме, — это точка, в которой жидкое и парообразное состояния существуют одновременно.Тщательно контролируя температуру, чтобы она находилась чуть выше точки плавления, можно визуально увидеть процесс плавления йода.
Вот короткое видео, демонстрирующее жидкое состояние йода:
Применение йода в современном мире
Небольшие количества минералов йода необходимы для производства жизненно важных гормонов щитовидной железы. Эти гормоны играют важную роль в организме человека и участвуют в контроле частоты сердечных сокращений, пищеварения, сокращения мышц и клеточного метаболизма.Следовательно, это важный элемент в индустрии разработки лекарств. Кроме того, в поваренную соль иногда добавляют йод. Это не только обеспечивает включение йода в рацион человека, но и помогает предотвратить зоб. Это заболевание, когда щитовидная железа набухает и производит либо дефицит, либо избыток гормонов щитовидной железы.
Элементарный йод может служить антисептиком. Как уже говорилось, йод и йодид калия (узнайте, что еще реагирует с йодидом калия здесь) образуют трииодид, KI 3 .Растворы, содержащие йодид калия в спирте, убивают микробы, существующие на внешних ранах. Такие соединения, как йодоформ (CHI 3 ), также являются антисептиками.
Многие могут быть знакомы с йодным раствором Люголя. Этот водный раствор почти гарантированно будет в любой биологической лаборатории. Этот фиолетовый раствор помогает ученым определить присутствие крахмала в веществе, поскольку раствор станет темно-синим.
История йода
Бернар Куртуа случайно обнаружил йод в 1811 году при извлечении хлорида калия из золы морских водорослей.После удаления соединения он добавил серную кислоту, чтобы еще больше обработать золу морских водорослей. Однако он добавил слишком много, создав облако пара фиолетового цвета. Этот газ конденсировался в кристаллы, которые химик сэр Хамфри Дэви позже идентифицировал как твердый йод в 1813 году.
Реакции йода
Йод — очень реактивный элемент. Он реагирует с водой с образованием гипойодита (OI — ). Гипойодит-ион нестабилен, и его трудно производить, так как он встречается только в растворе. Элемент также реагирует с горячей азотной кислотой и горячей щелочью с образованием йодистой кислоты и йодата соответственно.Йодная кислота действует как вяжущее средство и кристаллизуется при охлаждении; Йодат — это то, что добавляют в поваренную соль. Каким бы реактивным ни был йод, на него не влияют кислород или азот в воздухе.
Кроме того, йод легко возгоняется, то есть его твердое состояние испаряется при нагревании. При испарении образуется красивое темно-фиолетовое облако. Хотя на это облако приятно смотреть, важно избегать вдыхания, поскольку оно вызовет раздражение.
Часовые реакции йода
Часовые реакции йода весьма впечатляющие.В этом явлении два бесцветных раствора объединяются в другой прозрачный раствор. Затем почти спонтанно он переходит в темно-синий цвет. Это очень загадочный. В этой реакции сильный окислитель реагирует с сильным восстановителем. Примером является йодат калия (KIO 3 ), сильный окислитель, реагирующий с бисульфитом натрия (NaHSO 3 ), сильный восстановитель. Образуется йод.
Чтобы углубиться в детали, сначала мы начнем с раствора йодата калия и крахмала.Анионы бисульфита натрия снижают содержание йодата калия в этом растворе. При этом образуются йодидные анионы I — , которые реагируют с йодатом калия с образованием раствора йода. Затем этот новый раствор вступает в реакцию с йодом и образует трииодид-анионы, I 3 —. Бисульфитные анионы затем будут действовать на трииодид-анионы, что превращает их обратно в иодид-анионы. Когда этот процесс завершен, оставшиеся трийодид-анионы вступают в реакцию с молекулами крахмала, что мгновенно дает завораживающий темно-синий цвет.
Откуда взялось название? В зависимости от концентрации исходных веществ прозрачному раствору потребуется больше или меньше времени, чтобы стать синим — отсюда и название «часовая» реакция. Чем выше концентрация, тем быстрее будет скорость реакции. Во-вторых, скорость реакции увеличивается с повышением температуры. Наконец, добавление катализатора также ускорит реакцию.
Соединения йода
Трииодид азота = DISASTER
Когда йод вступает в реакцию с аммиаком, образуется твердое вещество, называемое трииодидом азота.Этот черный порошок — очень неорганическое неорганическое соединение. Когда кристаллы трииодида азота влажные, они стабильны. Когда кристаллы высыхают, они опасны — они чувствительны к прикосновениям и становятся взрывоопасными. В то время как небольшому взрыву не хватает мощности, чтобы нанести большой урон, большой взрыв, безусловно, сделает это. Держитесь подальше от сухого трииодида азота!
Разноцветные йодиды
Йодиды, в которых йод находится в отрицательной степени окисления, часто бывают белыми, но могут иметь различные цвета. Йодид серебра имеет более тусклый светло-желтый цвет, а йодид свинца выглядит как красивые желтые золотые пластинки, как вы можете видеть в эксперименте с золотым дождем.Иодид ртути (II) и иодид олова (IV) имеют красивый оранжево-красный цвет.
Синтез элемента йода
Метод получения йода заключается в сочетании иона йода с более сильным окислителем. Например, бром — более сильный окислитель, чем йод. Объединение двух ионов йода с водным Br2, форма I 2 и двух ионов брома ( 2 I — + Br 2 → I 2 + 2 Br — )
Простой способ приготовить йод, это смешать раствор йодида калия с соляной кислотой и перекисью водорода.Йод выпадает в осадок, и его легко фильтровать.
Степени окисления йода
Элементарный йод нейтрален и обладает степенью окисления 0. Однако, когда он присутствует в соединении, йод может иметь разные степени окисления и считается сильно кислым оксидом. В его соединениях наиболее распространенная степень окисления -1, что наблюдается в йодиде, I — . Это также видно в состояниях +7, +5, +3 и +1.
Оксианионы
Оксианионы — это многоатомные ионы, содержащие кислород.Четыре наиболее распространенных оксианиона йода — это гипойодит, IO — ; йодит, ИО 2 ; йодат, ИО 3 —; и периодат, ИО 4 —. Соответственно, они имеют степени окисления +1, +3, +5 и +7.
Гипойодиты представляют собой конъюгированное основание гипоиодной кислоты, так как оно образуется в результате депротонирования гипоиодистой кислоты. Этот одновалентный анион часто используется в качестве реагента для реакций прямого окисления.
Йодиды очень нестабильны и никогда не выделяются.В основном они используются в качестве промежуточного продукта при синтезе йодата из йодида.
Йодаты представляют собой сопряженное основание йодной кислоты. Они используются для часовых реакций йода.
Периодаты представляют собой сопряженное основание периодной кислоты, так как они являются продуктами депротонирования периодической кислоты. Они обычно используются в реакциях окисления, которые расщепляют связи между вицинальными атомами углерода и незамещенными гидроксильными или аминогруппами.
Свойства йода
- Точка плавления: 386.9 К; 113,7 ° С; 236,7 ° F
- Температура кипения: 457,6 К; 184,4 ° С; 363,9 ° F
- Естественное содержание в земной коре: 0,000049%
- Конфигурация электронной оболочки: [Kr] 4d10 5s2 5p5
- Изотопы: Йод-127 — единственный стабильный изотоп
- , обнаруженный в природе в: Нефтяные месторождения и месторождения каличевых руд; Еда; Морские водоросли
- Токсичность: Токсичен, особенно в больших количествах
Где я могу купить йод?
Купить элемент йода сложно, потому что он является засекреченным прекурсором для незаконного производства наркотиков, но в небольших количествах его можно приобрести на ebay.
Йод — это неметаллический, темно-серый / пурпурно-черный, блестящий твердый элемент. Йод — это самый электроположительный галоген и наименее реактивный из галогенов, даже если он все еще может образовывать соединения со многими элементами. Йод легко возгоняется при нагревании с образованием пурпурного пара. Йод растворяется в некоторых растворителях, например в четыреххлористом углероде, и лишь немного растворяется в воде. Применения Йод используется в медицине в виде настойки и йодиоформа, он используется при приготовлении некоторых лекарств и при производстве некоторых печатных красок и красок.Йод серебра используется в фотографии. Йод добавляют практически ко всей поваренной соли и используют в качестве добавки к корму для животных. Он также входит в состав таблеток для очистки воды, которые используются для приготовления питьевой воды. Йод в окружающей среде Йод добавляется практически в любой вид применяемой соли. Это ингредиент хлеба, морской рыбы и океанических растений. Йод естественным образом присутствует в океане, и некоторые морские рыбы и водные растения хранят его в своих тканях. Йод содержится в воздухе, воде и почве. Самым важным источником природного йода являются океаны. Около 400 000 тонн йода уходит из океанов каждый год в виде йодида в морских брызгах или в виде йодида, хлороводородной кислоты и йодистого метила, продуцируемого морскими организмами. Большая его часть откладывается на суше, где может стать частью биоцикла. Есть некоторые йодсодержащие минералы, такие как алутарит, найденный в Чили, и йодаргит, найденный в Колорадо, Неваде и Нью-Мексико.Мировое промышленное производство йода составляет около 13 000 тонн в год, в основном в Чили и Японии, а также в небольших количествах в России и США. Йод добывается из природных и нефтяных рассолов, которые содержат до 100 частей на миллион этого элемента или образуют чилийские нитратные отложения. Известные запасы легкодоступного йода составляют около 2 миллионов тонн.
Подробнее о йоде в воде Вернуться к периодической таблице элементов Предложения по теме: Йод Рекомендуемая суточная доза йода | — Новинка Мировая энциклопедия
Йод (химический символ I , атомный номер 53) представляет собой неметалл, который принадлежит к группе химических элементов, известных как галогены . При обычных температурах и давлениях это темно-серое / пурпурно-черное твердое вещество, которое легко сублимируется, то есть переходит непосредственно из твердой фазы в газовую. Газ имеет пурпурно-розовый цвет и имеет раздражающий запах. Название йод произошло от греческого слова iodes, что означает «фиолетовый». Элементарный йод разъедает кожу и токсичен при проглатывании. Однако в форме йодид-ионов йод необходим как микроэлемент для большинства живых организмов. У людей недостаток или избыток ионов йода может привести к отеку и нарушению работы щитовидной железы. Йод и его соединения имеют множество применений. Например, настойку йода используют для дезинфекции ран и дезинфекции питьевой воды. Йодид серебра используется в фотографии, а йодид вольфрама используется для стабилизации нитей в лампочках. Ряд органических соединений, содержащих йод, можно использовать при приготовлении фармацевтических препаратов и красителей. Радиоактивные изотопы йода-123 и йода-125 используются в качестве датчиков для визуализации щитовидной железы и оценки ее состояния. Искусственный радиоактивный изотоп, йод-131, используется для лечения рака щитовидной железы. происшествиеЙод встречается в природе в форме иодид-ионов, главным образом в растворах в морской воде, но также в некоторых минералах и почвах. Хотя этот элемент встречается довольно редко, он сконцентрирован в ламинарии и некоторых других растениях, которые помогают ввести элемент в пищевую цепочку и снизить его стоимость. ОткрытиеЙод был открыт в 1811 году французом Бернаром Куртуа, когда он работал со своим отцом над производством селитры (нитрата калия).В то время армия Наполеона вела войну, и селитра, ключевой компонент пороха, пользовалась большим спросом. Процесс производства селитры из французских пластов селитры требовал карбоната натрия, который можно было выделить из пепла сожженных морских водорослей. Оставшиеся отходы были уничтожены добавлением серной кислоты. Однажды Куртуа добавил слишком много серной кислоты, и поднялось облако пурпурного пара. Пар конденсируется на холодных поверхностях с образованием темных кристаллов. Куртуа провел несколько экспериментов, которые заставили его подозревать, что это новый элемент, но у него не было средств для продолжения своих наблюдений.Поэтому он дал образцы материала своим друзьям Шарлю Бернару Дезорму (1777–1862) и Николя Клеману (1779–1841) для продолжения исследований. Он также передал часть вещества Жозефу Луи Гей-Люссаку (1778–1850), известному в то время химику, и Андре-Мари Амперу (1775–1836). 29 ноября 1813 года Дезорм и Клеман обнародовали открытие Куртуа, описав вещество на собрании Императорского института Франции. 6 декабря Гей-Люссак объявил, что новое вещество представляет собой элемент или соединение кислорода.Ампер передал часть своего образца Хэмфри Дэви (1778–1829). Когда Дэви экспериментировал с этим веществом, он отметил его сходство с хлором. Дэви отправил письмо Лондонскому королевскому обществу от 10 декабря, в котором заявил, что обнаружил новый элемент. Между Дэви и Гей-Люссаком разгорелся серьезный спор по поводу того, кто первым определил йод, но оба ученых признали Куртуа первым, кто выделил это вещество. ИзоляцияЕсть несколько методов выделения йода.
Отличительные характеристикиВ периодической таблице йод расположен в группе 17 (бывшая группа 7A), семействе галогенов, между бромом и астатом. Кроме того, он находится в периоде 5, между теллуром и ксеноном.Молекулярная формула йода I 2 . В химическом отношении йод образует соединения со многими элементами, но из галогенов он наименее активен. Кроме того, это самый электроположительный галоген после астата и обладает некоторыми металлическими свойствами. Он слабо растворяется в воде, образуя желтый раствор, но легко растворяется в хлороформе, четыреххлористом углероде или сероуглероде с образованием пурпурных растворов. Свободный элемент образует с крахмалом комплекс темно-синего цвета. Йод не реагирует с кислородом или азотом, но с озоном образует нестабильный оксид, I 4 O 9 . При смешивании с водой он реагирует с образованием ионов гипойодита (OI — ). При соответствующих условиях йод реагирует с другими галогенами — фтором, хлором и бромом — с образованием «межгалогенных» соединений, включая IF 3 , IF 5 , IF 7 , ICl, I 2 Cl 6 , и BrI. При смешивании с аммиаком йод может образовывать трииодид азота, который чрезвычайно чувствителен и может неожиданно взорваться. Самыми распространенными соединениями йода являются йодиды натрия и калия (NaI, KI) и йодаты (NaIO 3 , KIO 3 ). ИзотопыСуществует 37 изотопов йода, из которых только один, 127 I, является стабильным. Изотоп 129 I с периодом полураспада 15,7 миллиона лет образуется в атмосфере Земли, когда ядра 130 Xe поражаются космическими лучами высокой энергии. Он также образуется при делении урана и плутония как в подземных породах, так и в ядерных реакторах.Переработка ядерного топлива и испытания ядерного оружия в атмосфере теперь заглушили естественный сигнал для этого изотопа. В гидрологических исследованиях концентрации 129 I обычно указываются как отношение 129 I к общему количеству I (что фактически составляет 127 I). Это отношение в природе довольно мало, в пределах от 10 −14 до 10 −10 (пиковое значение термоядерного 129 I / I в течение 1960-х и 1970-х годов достигло примерно 10 −7 ). 129 I встречается в нескольких ионных формах (обычно I — и IO 3 — ) и легко проникает в биосферу, встраиваясь в растительность, почву, молоко и ткани животных. Избыточные количества стабильного 129 Xe в метеоритах, по-видимому, являются результатом распада «изначального» 129 I, произведенного сверхновыми звездами, которые создали пыль и газ, из которых сформировалась Солнечная система. Распад 129 I является основой йодно-ксеноновой радиометрической схемы датирования, которая охватывает первые 50 миллионов лет развития Солнечной системы. СоединенияЙод содержится в большом количестве органических и неорганических соединений.В случае органических соединений химики могут заменять атомы водорода атомами йода, создавая таким образом множество новых продуктов. Список известных неорганических соединений йода приводится ниже в алфавитном порядке.
Биологическая роль йодаЙод — важный микроэлемент в организме человека.Гормоны щитовидной железы тироксин (T4) и трийодтиронин (T3) содержат четыре и три атома йода на молекулу соответственно. Щитовидная железа активно поглощает элементарный йод из крови, чтобы производить и выпускать эти гормоны в кровь, действия, которые регулируются вторым гормоном (тиреотропный гормон, ТТГ) из гипофиза. Гормоны щитовидной железы филогенетически очень стары, так как они синтезируются большинством многоклеточных организмов и даже имеют некоторое влияние на одноклеточные.Эти гормоны играют очень важную роль в биологии, воздействуя на митохондрии, регулируя метаболизм. Т4 действует в основном как предшественник Т3, который (за некоторыми незначительными исключениями) является биологически активным гормоном. Дефицит йодаДефицит йода — серьезная проблема в различных частях земного шара. Это особенно влияет на людей в местах, где в рационе мало йода, как правило, в удаленных внутренних районах. районы и полузасушливый экваториальный климат, где не употребляют в пищу морские продукты.Дефицит йода приводит к зобу. Это также основная причина предотвратимой умственной отсталости. РационУправление по санитарному надзору за качеством пищевых продуктов и медикаментов США рекомендует употреблять 150 мкг йода в день как для мужчин, так и для женщин. Это необходимо для правильного производства и функционирования гормонов щитовидной железы. Природные источники йода включают морские водоросли и морепродукты. Токсичность йода
ПриложенияИспользование нерадиоактивного йода
Использование радиоактивного йода
См. ТакжеСписок литературыВнешние ссылкиВсе ссылки получены 5 марта 2018 г. кредитовЭнциклопедия Нового Света писателей и редакторов переписали и завершили статью Википедия в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с указанием авторства. Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников Энциклопедии Нового Света, , так и на самоотверженных добровольцев Фонда Викимедиа.Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних публикаций википедистов доступна исследователям здесь: История этой статьи с момента ее импорта в New World Encyclopedia : Примечание. Некоторые ограничения могут применяться к использованию отдельных изображений, на которые распространяется отдельная лицензия.
I Информация об элементе йода: факты, свойства, тенденции, использование и сравнение — Периодическая таблица элементовИстория йодаЭлемент Йод был открыт Бернаром Куртуа в год. 1811 г. во Франции .Йод получил свое название от французского iode (от греческого ioeides, «фиолетовый») Присутствие йода: изобилие в природе и вокруг насВ таблице ниже показано содержание йода во Вселенной, Солнце, Метеоритах, Земная кора, океаны и человеческое тело. Кристаллическая структура йодаТвердотельная структура йода — орторомбическая с центром по основанию . Кристаллическую структуру можно описать с помощью ее элементарной ячейки. Элементарные ячейки повторяются в три пространственное пространство для формирования конструкции. Параметры элементарной ячейкиЭлементарная ячейка представлена в терминах ее параметров решетки, которые являются длинами ячейки края Константы решетки ( a , b и c )
и углы между ними Решетки Углы (альфа, бета и гамма).
Положения атомов внутри элементарной ячейки описываются набором атомных положений ( x i , y i , z i ), измеренные от опорной точки решетки. Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможно симметричное расположение частиц в трехмерном пространстве описывается 230 пространственными группами (219 различных типов или 230, если хиральные копии считаются отдельными. Атомные и орбитальные свойства йодаАтомы йода имеют 53 электрона и структура электронной оболочки [2, 8, 18, 18, 7] с символом атомного члена (квантовые числа) 2 P 3/2 . Оболочечная структура йода — количество электронов на энергию уровень
Основное состояние электронной конфигурации йода — нейтраль Атом йодаЭлектронная конфигурация нейтрального атома йода в основном состоянии [Кр] 4д10 5с2 5п5.Часть конфигурации йода, которая эквивалентна благородному газу предыдущий период сокращенно обозначается [Kr]. Для атомов с большим количеством электронов это нотация может стать длинной, поэтому используется сокращенная нотация. валентные электроны 4d10 5s2 5p5, электроны в внешняя оболочка, определяющая химические свойства элемента. Полная электронная конфигурация нейтрального йодаПолная электронная конфигурация основного состояния для атома йода, несокращенная электронная конфигурация 1с2 2с2 2п6 3с2 3п6 3d10 4с2 4п6 4д10 5с2 5п5 Атомная структура йодаАтомный радиус йода 115 пм, а его ковалентный радиус 133 пм. Атомный спектр йодаХимические свойства йода: Энергии ионизации йода и сродство к электронуЭлектронное сродство йода составляет 295,2 кДж / моль. Энергия ионизации йодаЭнергия ионизации йода см. В таблице ниже.
Физические свойства йодаФизические свойства йода указаны в таблице ниже.
Упругие свойстваТвердость йода — Испытания для измерения твердости элементаЭлектрические свойства йодаЙод — изолятор электричества. Ссылаться на стол ниже электрические свойства йода Свойства йода по теплопроводности и теплопроводностиМагнитные свойства йодаОптические свойства йодаАкустические свойства йодаТермические свойства йода — энтальпии и термодинамикаТермические свойства йода см. В таблице ниже.Энтальпия йодаИзотопы йода — ядерные свойства йодаИзотопы родия.Встречающийся в природе йод имеет 1 стабильный изотоп — 127I.
Нормативно-правовое регулирование и здравоохранение — Параметры и рекомендации по охране здоровья и безопасностиПоиск в базе данныхСписок уникальных идентификаторов для поиска элемента в различных базах данных химического реестра Изучите нашу интерактивную таблицу Менделеева Сравнение элементов периодической таблицы Йод | Периодическая таблица | The GuardianЭлемент этой недели, йод, вероятно, гораздо более знаком вам, чем некоторые из предыдущих, о которых мы говорили недавно.Йод обозначается символом I и атомным номером 53, а его название происходит от греческого слова, обозначающего фиолетовый или пурпурный, который представляет собой цвет паров элементарного йода. Фиолетовый? ты спрашиваешь. Да, фиолетовый. Один только этот персонаж делает йод забавным, поскольку это не только отход от обычных вариаций серой цветовой темы для большинства элементов, но и радикальный отход от пурпурного . Кроме того, кристаллы элементарного йода довольно привлекательны, они черные и блестящие. Йод используется в промышленности в качестве катализатора для ускорения других химических реакций, особенно при производстве коммерческих количеств уксусной кислоты (уксуса), а также имеет множество применений в фармацевтической промышленности. Но главное значение йода — биологическое: это важный элемент для животных. Щитовидная железа синтезирует несколько гормонов, трийодиотиронин (Т3) и тироксин (Т4), которые содержат этот элемент. По этой причине, а также из-за того, что йод встречается довольно редко, щитовидная железа концентрирует йод.Обычно это хорошо, но это может создавать проблемы, когда тело залито радиоактивными изотопами йода. Накопление радиоизотопов йода, в частности йода-131, период полураспада которого составляет 8 дней, канцерогенен для щитовидной железы. Это причина предоставления населению таблеток йодида калия после ядерной катастрофы, такой как авария на Фукусиме, потому что обеспечение организма большим притоком нерадиоактивного изотопа I-127 насыщает щитовидную железу, поэтому она не может поглощать радиоизотопы йода. Йод присутствует в виде водорастворимых ионов в морской воде, морской соли и в ряде морских растений, особенно в водорослях. Но вдали от побережья, во внутренних и горных регионах мира, дефицит йода — это предотвратимая трагедия общественного здравоохранения. Поскольку гормоны щитовидной железы, Т3 и Т4, регулируют гены, которые регулируют рост, развитие и метаболизм у животных, дефицит йода имеет серьезные последствия: это ведущая предотвратимая причина умственной отсталости, зоба (известного как «Дербиширская шея» в некоторых частях тела). Великобритания), и это способствует развитию ряда видов рака.Эти проблемы со здоровьем можно легко решить, добавив йод в соль, муку, воду и молоко в местах, где его не хватает. Кроме того, стоимость добавления йода в пищу незначительна, но социальные последствия бездействия огромны, что приводит к расходам на здравоохранение в миллиарды долларов каждый год. Удивительно, но некоторые страны, в первую очередь Россия, не реализовали государственные программы, направленные на восполнение дефицита йода у своих граждан. Йод является важным элементом и для других животных, особенно для земноводных.T3 и T4 регулируют гены, которые контролируют метаморфоз из водных головастиков, дышащих водой, в взрослых наземных животных, дышащих воздухом. Головастики, страдающие дефицитом йода, остаются головастиками до конца своих дней. Интересно, что водные саламандры, известные как грязевые щенки, Necturus maculosus , никогда не превращаются во взрослую форму не из-за недостатка йода в окружающей среде, а потому, что они устойчивы к метаморфическим эффектам йода и гормонов щитовидной железы [PMID: 16686639] . Вот наш любимый профессор химии, рассказывающий нам больше о чудесах йода: Посетите канал PeriodicVideos на YouTube [ссылка на видео]. .. .. .. .. .. .. .. .. .. .. .. .. Видеожурналист Брэди Харан — человек с камерой, а Ноттингемский университет — это место, где живут химики. Вы можете следить за Брэди в твиттере @periodicvideos и за Университетом Ноттингема в твиттере @UniNottingham Вы уже встречали эти элементы: Теллур: Te , атомный номер 52 Вот Интерактивная Периодическая таблица элементов Королевского химического общества, которая на самом деле , действительно , с которой весело играть! . | ||||||||||||||

 Сероводород H2 S , Na 2 S2 O3 и другие восстановители восстанавливают его до иона I− :
Сероводород H2 S , Na 2 S2 O3 и другие восстановители восстанавливают его до иона I− :